MECANISMO DE LA REACCIÓN
.
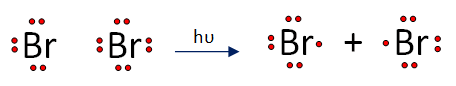
Es la interpretación teórica de los pasos seguidos en la interacción de los reaccionantes para generar los productos de reacción, así en la halogenación del etano se distinguen 3 pasos:
1. Iniciación.- Ruptura fotoquímica de la molécula de halógeno.
2. Propagación.- El radical Br sustrae un hidrógeno del etano, a su vez este radical colisiona con la otra molécula de bromo.
3. Terminación.- Los radicales libres presentes entran en colisión y se combinan.
Ejemplo 2: El metano reacciona con cloro a 250°C, si se mantiene esta temperatura en el reactor, progresivamente se generan nuevos productos.

Nitración
Logran nitrarse, al reaccionar con acido nítrico concentrado, sustituyendo hidrogeno por el grupo Nitro (NO2). Esta reacción a presión atmosférica, en fase vapor o temperaturas entre 420 a 475°C y en presencia de ácido sulfúrico.
Ejemplo
Ciclación
A temperaturas entre 500 y 700°C, logran deshidrogenarse en presencia de catalizadores especiales que son Cr2O3 ó Al2O3 ; los alcanos de seis a diez átomos de carbono dan hidrocarburos aromáticos monocíclicos.
Ejemplo 1: Ciclación del heptano
ALQUENOS
La fórmula general de los alquenos es:
CnH2n
El tipo de enlace es:
Los alquenos son aquellos hidrocarburos donde
existe un enlace doble entre átomos de carbono.
Nomenclatura
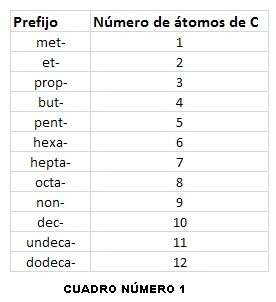
Según el número de carbonos, se usa el mismo prefijo que los alcanos, pero con la terminación “eno”. Usaremos esta tabla, según sea el número de átomos de carbono:
Propiedades Físicas
· 1. Estado Físico: los tres primeros miembros
son gases a temperatura ordinaria, del C5 hasta el C18 son líquidos y los demás
sólidos.
· 2. Puntos de Ebullición: son un poco más bajos (algunos
grados) que los alcanos.
· 5. Solubilidad: aunque débil, es
considerablemente más alta que la de los alcanos, debido a que la concentración
de los electrones en el doble enlace, produce una mayor atracción del extremo positivo
del dipolo de la molécula de agua.
Propiedades Químicas
· 1. Combustión: en presencia del calor producido
por una llama reaccionan con el oxígeno atmosférico, originando CO2
y H2O y constituye una combustión completa en la reacción se libera
gran cantidad de calor.
·
2. Adición de un reactivo isométrico: X2 (H2, Cl2, Br2).
·
Hidrogenación: adición de una molécula de
hidrógeno (H2 ó H-H) al ponerlos en contacto con el hidrógeno (H2) en presencia
de un catalizador tal como el Pt, Pd ó Ni finalmente divididos, dan origen a
alcanos.
El doble enlace se rompe.
· Halogenación: adición de una molécula de
halógeno (X2, donde X es F, Cl, Br ó I) y reaccionan con el (Br - Br),
disuelto en (CCl4), a temperatura ambiente y en ausencia de luz. La
reacción de adición se presenta así:
El Br disuelto en CCl4 es un reactivo útil para distinguir entre
alquenos y alcanos, ya que estos últimos no reaccionan con él.
·
Adición de haluros de hidrógeno: HY = HX, donde X es Cl, Br ó I
La adición de haluros de hidrógeno al doble enlace de un alqueno, da lugar
al derivado monohalogenado llamado halogenuro de alquilo o haluro de alquilo,
de fórmula general RX.
·
Adición de ácido sulfúrico: H2SO4 (H – OSO3H)
Cuando los alquenos se tratan en frío con ácido sulfúrico concentrado,
reaccionan por adición (sigue la regla de Markonikov), formando el sulfato
ácido de alquilo correspondiente de fórmula ROSO3H.
·
Adición de ozono (O3): ozonólisis
Se utiliza esta reacción para localizar el doble enlace. La reacción del
ozono con unos alquenos conduce a la formación de un ozónido. Algunos ozónidos
son inestables cuando están secos y pueden explotar con gran violencia. Ordinariamente no se aíslan, sino que la mezcla de reacción se trata en
condiciones reductoras, dando aldehidos y cetonas como productos.
ALQUINOS
Los alquinos también
son conocidos como hidrocarburos acetilénicos.
La fórmula
general de los alquinos es:
CnH2n-2
Los
alquinos son aquellos hidrocarburos donde existe un enlace triple entre
los átomos de carbono.
Nomenclatura
Encontramos
dos tipos de nomenclatura:
Común
Al
alquino más sencillo C2H2 se le llama acetileno. Para alquinos de pocos carbonos, se emplean
nombres derivados del acetileno, nombrando radicales y al final el nombre del
acetileno.
Ejemplo 1: Acetileno
Ejemplo 2: Dimetilacetileno
Ejemplo 3: Vinilacetileno
IUPAC
Se
usa la terminación INO,
con el prefijo según el número de carbonos.
Para alquinos de más de 3 carbonos, se numera la
cadena continua más larga, incluyendo los carbonos con triple enlace, de modo
que estos tengan los números más bajos.
Propiedades Físicas
· 1. Estado Físico: son gases hasta el C5,
líquidos hasta el C15 y luego sólidos
· 2. Puntos de Ebullición: son más altos que los de los correspondientes alquenos y alcanos
· 3. Puntos de Fusión: se puede decir lo mismo que para el punto de ebullición
· 4. Densidad: igual que en los casos
anteriores
· 5. Solubilidad: se disuelven en solventes no polares
Propiedades Químicas
· 1. Combustión: en presencia de calor
producido por una llama, los alquinos reaccionan con el oxígeno atmosférico,
originando dioxido de carbono (g) y agua, lo cual constituye una combustión
completa.
· 2. Hidrogenación: la hidrogenación catalítica
(Ni, Pt, Pd) conduce primero a la formación de un alqueno y luego a la del
alcano correspondiente.
· 3. Halogenación: los alquinos en presencia
de un catalizador reaccionan con dos moléculas de halógeno, originando los
tetrahaluros de alquilo.
· 4. Adición de haluros de hidrógeno (HCl, HBr): la adición de haluros de hidrógeno al triple enlace, conduce a la formación
de dihaluro geminal.
· 5. Adición de agua: se utiliza para formar
etanal (aldehído con dos átomos de carbono), el cual puede oxidars luego a
ácido acético (ácido orgánico con dos átomo de carbono).
· 6. Los alquinos como ácidos: los metales alcalinos como el Na y K desplazan los hidrógenos del acetileno
(hidrógenos ácidos). Los alquinos terminales forman tambien derivados metálicos
con plata e iones cuprosos.
7. Oxidación de los alquinos: cuando los alquinos se tratan con el reactivo Baeyer sufren una ruptura
oxidativa en forma similar a la que se produce en los alquenos. Los productos
de la reacción (después de la acidificación) son ácidos carboxílicos fáciles de
identificar.
HIDROCARBUROS AROMÁTICOS
Son hidrocarburos de cadena cerrada que tienen propiedades características que los diferencian de los hidrocarburos acíclicos. Estos compuestos son derivados del benceno y se clasifican en:
Monocíclicos:
Son aquellas moléculas que están formadas por
un solo anillo (o ciclo) aromático, así por ejemplo:
Policíclicos
Están constituidos por dos o más anillos
bencénicos, debido a ello son denominados también hidrocarburos bencénicos o
bencenoides, así por ejemplo:
Compuestos Oxigenados
ALCOHOLES
Resultan de la sustitución de uno o varios átomos de hidrógeno (H) por grupos hidroxilo (-OH) en los hidrocarburos saturados o no
saturados.
Propiedades Físicas
El punto de fusión y ebullición de los
alcoholes, crece con el aumento del tamaño de la
molécula, con 12 o
menos átomos de carbono en la estructura son líquidos a temperatura ambiente,
ya con más de 12 son sólidos.
La solubilidad en agua se reduce con el aumento del peso
molecular, de esta forma, el metanol, etanol y propinol son solubles en agua en
cualquier proporción, a partir de 4 o más átomos de carbono la solubilidad
comienza a disminuir de modo que, a mayor peso molecular, menor
solubilidad.
Propiedades Químicas
· Reacción con los metales
alcalinos y alcalinos-térreos.
Reaccionan
con estos metales igualmente como lo hace el agua, pero con menos violencia,
para formar lo que se conoce como alcóxidos
Na
+ CH3CH2OH ---------------> CH3CH2ONa +
½H2
· Reacción con los ácidos.
Reaccionan
con los ácidos orgánicos e inorgánicos fuertes para formar los ésteres.
Los ésteres obtenidos de ácidos inorgánicos es frecuente encontrarlos como
ésteres inorgánicos.
CH3OH
+ SO4H2 ---------------> CH3O-SO2-OCH3
Metanol + Ácido sulfúrico -----------------> Sulfato de metilo.
Metanol + Ácido sulfúrico -----------------> Sulfato de metilo.
· Deshidrogenación
Los alcoholes primarios y secundarios cuando se calientan en contacto con ciertos catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas. Si esta deshidrogenación se realiza en presencia de aire (O) el hidrógeno sobrante se combina con el oxígeno para dar agua.
Los alcoholes primarios y secundarios cuando se calientan en contacto con ciertos catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas. Si esta deshidrogenación se realiza en presencia de aire (O) el hidrógeno sobrante se combina con el oxígeno para dar agua.
Clases
Un
alcohol es primario, si el átomo de (H) sustituido por el grupo oxidrilo (-OH)
pertenece a un (C) primario:
Es secundario, si el átomo de (H) sustituido por el grupo oxidrilo (-OH)
pertenece a un (C) secundario:
Finalmente,
es terciario, si el átomo de (H) sustituido por el grupo oxidrilo (-OH)
pertenece a un (C) terciario:
ALDEHÍDOS
Resultan de la oxidación suave y la deshidratación de los alcoholes primarios.
El grupo funcional es
el carbonilo al igual que la cetona con la diferencia que en los aldehídos van
en un carbono primario, es decir, de los extremos.
Nomenclatura:
Al
nombrar tenemos que cambiar la terminación de los alcoholes “ol” por la
terminación “al”. Como el ejemplo expuesto arriba, Etanol pasa a Etanal.
También
existen aldehídos con dobles enlaces sobre la cadena hidrocarbonada.
En
estos casos se respeta la nomenclatura de los alquenos que utilizan las
terminaciones “eno”. Por ejemplo:
También
pueden coexistir dos grupos aldehídos en la misma molécula. Ejemplo:
Propanodial
Aldehídos
aromáticos: En estos casos el grupo funcional aldehído esta unido al anillo o núcleo
aromático.
La
preparación de aldehídos alifáticos se basa en la oxidación de los alcoholes.
Propiedades Físicas
Los
de pocos carbonos tienen olores característicos. El metanal produce lagrimeo y
es gaseoso. Hasta el de 12 carbonos son líquidos y los demás sólidos.
Los puntos de ebullición son menores que los alcoholes respectivos de igual cantidad
de carbonos.
Todos
son de menor densidad que el agua. Los más chicos presentan cierta solubilidad
en agua, pero va disminuyendo a medida que aumenta la cantidad de carbonos.
Propiedades Químicas
Los
aldehídos tienen buena reactividad. Presentan reacciones de adición,
sustitución y condensación.
De adición:
Adición de Hidrógeno: El hidrógeno se adiciona y se forma un alcohol primario.
Adición de Oxígeno: El oxígeno oxida al aldehído hasta transformarlo en ácido.
Reducción del
Nitrato de plata (AgNO3) amoniacal (Reactivo de Tollens).
La
plata en medio amoniacal es reducida por el aldehído. Esto se verifica por la
aparición de un precipitado de plata llamado espejo de plata en el fondo del
tubo d ensayo.
En
primer lugar se forma hidróxido de plata.
AgNO3 + NH4OH
→ NH4NO3 +
AgOH
Posteriormente
la plata es reducida hasta formar el espejo de plata.
Reducción del
Licor de Fehling:
El
licor de Fehling está conformado de dos partes.
I)
Una solución de CuSO4
II)
NaOH y Tartrato doble de Na y K.
Al
reunir ambas soluciones se forma hidróxido cúprico:
CuSO4 + 2 NaOH
→ Na2SO4 +
Cu(OH)2
Este
hidróxido con el tartrato, forma un complejo de color azul intenso. Cuando a
esta mezcla se le agrega un aldehído, y se la somete al calor, el cobre de valencia II se reducirá a cobre devalencia I. el aldehído se oxidará como en el
caso anterior formando un ácido orgánico. La reducción del cobre se evidencia
por la aparición de un precipitado rojo de óxido cuproso.
Sustitución con
halógenos:
Los
aldehídos reaccionan con el cloro dando cloruros de ácidos por sustitución del
hidrógeno del grupo carbonilo.
Aldolización:
Esta
dentro de las reacciones de condensación. Se da
cuando dos moléculas de aldehído se unen bajo ciertas condiciones como la
presencia de hidróxidos o carbonatos alcalinos.
Al
unirse se forma una molécula que tiene una función alcohol y otra función
aldehído en la misma molécula. A
este compuesto también se lo llama aldol por la combinación entre un alcohol y
un aldehído.
Reacción
indicadora de la presencia de aldehídos: El
reactivo llamado de Schiff es una solución de fucsina (colorante rojo
violáceo). Este reactivo se puede decolorar con ciertos reactivos como el SO2 hasta volverlo incoloro. Pero cuando
se le agrega una solución que contenga aldehído, el reactivo vuelve a tomar su
color rojo violáceo.
CETONAS
Y su grupo funcional se llama grupo carbonilo y es:
El carbonilo es el átomo de carbono unido a uno de oxígeno a través
de un doble enlace. Las otras dos valencias se encuentran ocupadas por dos
radicales de hidrocarburos que pueden ser cadenas carbonadas o anillos
aromáticos.
Nomenclatura
Se nombran agregando la terminación o sufijo “ona” al hidrocarburo de
base. Como se vio en el ejemplo. Si tiene 3 carbonos deriva del propano,
propanona. Si fuera lineal de 4 carbonos derivaría del butano, butanona, etc.
Ya a partir de 4 carbonos es necesario agregar un número que indicará el
lugar donde se ubica el grupo funcional cetona (grupo carbonilo).
Propiedades Físicas
1)Estado físico: son líquidas las que tienen hasta 10 carbonos, las más grandes son sólidas.
1)Estado físico: son líquidas las que tienen hasta 10 carbonos, las más grandes son sólidas.
2)Olor: Las pequeñas
tienen un olor agradable, las medianas un olor fuerte y desagradable, y las más
grandes son inodoras.
3)Solubilidad: son insolubles
en agua (a excepción de la propanona) y solubles en éter, cloroformo, y
alcohol.
4) Punto de
ebullición: es mayor que el de los alcanos de igual peso molecular,
pero menor que el de los alcoholes y ácidos carboxílicos en iguales
condiciones.
Propiedades Químicas
Reacciones de adición
Reacciones de hidratación de cetonas
Al añadir una
molécula de agua H-OH al doble enlace carbono-oxígeno, resulta un diol. Si se
produce un diol con los dos grupos –OH unidos al mismo tiempo, se le llama
hidrato. En la reacción de formación de estos, el grupo –OH del agua se une al
átomo de carbono del carbonilo, mientras que el –H al átomo de oxígeno
carbonilo.
Adición de alcoholes
Al adicionar
alcoholes (ROH) a las cetonas se producen hemicetales. No obstante, los
hemicetales no son estables, tienen un bajo rendimiento y en su mayoría no
pueden aislarse de la solución.
Adición de
amoníaco y sus derivados
Las cetonas reaccionan con el amoníaco NH3, o con
las aminas para formar un grupo de sustancias llamadas iminas o bases de
Schiff. Las iminas resultantes son inestables y continúan reaccionando para
formar, eventualmente, estructuras más complejas.
Reacción general
Adición del reactivo de Grignard
Son compuestos
organometálicos utilizados en numerosas reacciones orgánicas de síntesis. Al
reaccionar dicho reactivo con una cetona se forman alcoholes terciarios con
cadenas carbonadas más largas que los compuestos carbonilos que los originaron.
Al ser el reactivo de Grignard polarizado debido a la diferencia en las
electronegatividades del carbono y del magnesio, ataca primero al oxígeno del
carbonilo para después atacar al carbono carbonilo. Como resultado de esta
reacción, se obtiene un alcohol terciario.
Reacción general:
Reacción de
sustitución
Halogenación
Se da cuando una cetona está en presencia de una base fuerte. La reacción
de sustitución ocurre en el carbono contiguo al grupo funcional. No obstante,
puede reaccionar más de un halógeno, sustituyendo los hidrógenos pertenecientes
a la cadena.
Obtención:
Las cetonas se
pueden obtener a partir de reacciones químicas y las que se encuentran en la
naturaleza. Respecto a las reacciones, los métodos más importantes son mediante
la oxidación de alcoholes secundarios, ozonólisis de alquenos, hidratación de
alquinos, y a partir de reactivos de Grignard.
Oxidación de alcoholes secundarios
Siendo el método más utilizado, los oxidantes que se usan son dicromato de
potasio K2Cr2O7, trióxido de cromo CrO3, y permanganato de potasio KMnO4 diluidos en piridina o acetona. Las cetonas, al
ser obtenidas mediante esta oxidación, son resistentes a una posterior, por lo
que se pueden aislar del oxidante con facilidad.
Ozonólisis de alquenos
Se forman las
cetonas mediante la ruptura de alquenos con ozono, seguida de una reducción
suave. La ozonólisis se puede usar como método de síntesis o como técnica
analítica gracias a que los rendimientos son buenos.
Reacción general:
Ejemplo:
Hidratación de alquinos
Se le adiciona agua
a los alquinos en los carbonos que contienen el triple enlace, mediante
catalizadores como mercurio Hg y ácido sulfúrico H2SO4.
De esta manera se obtiene como resultado una cetona.
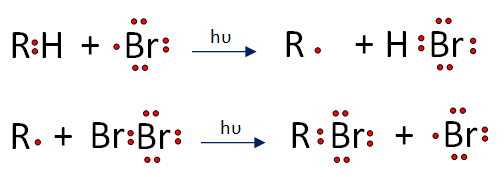






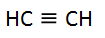
















No hay comentarios:
Publicar un comentario